خصوصیات سلول هاي مزانشیمی ماتريکس بند ناف انسان

خصوصیات سلول هاي مزانشیمی ماتريکس بند ناف انسان
سید نورالدین نعمتاللهی ماهانی (.Ph.D)
1- گروه علوم تشریح، دانشکده پزشکی افضلیپور، دانشگاه علوم پزشکی و خدمات بهداشتیـ درمانی کرمان، کرمان، ایران
2- مرکز تحقیقات علوم اعصاب، دانشگاه علوم پزشکی و خدمات بهداشتیـ درمانی کرمان، کرمان، ایران
محمد رضازادهکرمانی (.M.D)
مرکز تحقیقات دانشجویی، دانشکده پزشکی افضلیپور، دانشگاه علوم پزشکی و خدمات بهداشتیـ درمانی کرمان، کرمان، ایران
مصطفی لطیفپور (.M.Sc)
1- گروه علوم تشریح، دانشکده پزشکی افضلیپور، دانشگاه علوم پزشکی و خدمات بهداشتیـ درمانی کرمان، کرمان، ایران
2- مرکز تحقیقات علوم اعصاب، دانشگاه علوم پزشکی و خدمات بهداشتیـ درمانی کرمان، کرمان، ایران
پروین صالحینژاد (.Ph.D)
1- دانشکده پرستاری، دانشگاه علوم پزشکی و خدمات بهداشتیـ درمانی کرمان، کرمان، ایران
2- انستیتو علوم زیستی، دانشگاه پوترا، کرمان، ایران
زمینه و هدف: در سالهای اخیر، سلول درمانی بعنوان روشی سودمند در درمان بیماریهای مختلف به ویژه بیماریهای مضمحلکننده دژنراتیو پیشنهاد شده است. سلولهای مزانشیمی ماتریکس بند ناف، در زمره سلولهای بنیادی هستند که اخیراً مورد توجه قرار گرفتهاند. در مطالعه حاضر، ضمن معرفی شرایط کشت این سلولها، پارهای ویژگیها از قبیل بیان آنزیم آلکالین فسفاتاز، توان تولید کلنی در قطره معلق و میزان رشد در تراکمهای مختلف در این سلولها بررسی شده است.روش بررسی: در این مطالعه تجربی، بند ناف نوزاد تازه متولد شده به روش سزارین از بیمارستان افضلیپور کرمان تهیه شد و در شرایط استریل به آزمایشگاه منتقل و به روش کشت قطعه بافت، در محیط کشت مناسب کشت داده شد. پس از رسیدن رشد سلولها به تراکم بیش از 80%، سلولها پاساژ داده شدند و به تعداد 1061 سلول در پلیتهای مخصوص کشت داده شدند و ویژگیهای رشد این سلولها بررسی شد. پس از تشکیل کلنی، کلنیهای سلولی با کیت آلکالین فسفاتاز رنگآمیزی شدند. همچنین تعداد 1051 سلول در قطرات معلق قرار گرفته و پس از 48 ساعت از نظر تشکیل کلنی و بیان آنزیم آلکالین فسفاتاز بررسی شدند. همچنین سلولها به تعداد 125، 250، 500، و 1000 سلول در l100 محیط کشت بمدت 48 ساعت کشت داده شدند و میزان فعالیت میتوکندری سلولها در گروههای مختلف با کیت Wst-1 بررسی شد.نتایج: سلولهای مزانشیمی ماتریکس بند ناف انسان در محیط کشت، پس از 8 تا 10 روز کلنیهای سلولی تشکیل دادند که آلکالین فسفاتاز مثبت بودند. کشت سلولها در قطرات معلق نیز به تولید کلنیهای آلکالین فسفاتاز مثبت منجر شد. افزایش تراکم سلولی در ابتدای کشت، باعث ازدیاد میزان فعالیت میتوکندری سلولها پس از 48 ساعت نگهداری در انکوباتور شد.نتیجهگیری: یافتههای مطالعه حاضر نشان میدهد که سلولهای مزانشیمی ماتریکس بند ناف انسان قادرند در محیط کشت علاوه بر تک لایه سلولی، کلنیهای آلکالین فسفاتاز مثبت تشکیل دهند. از سوی دیگر سلولهای مزانشیمی بند ناف قادرند در قطره معلق رشد کرده و کلنیهای آلکالین فسفاتاز مثبت تشکیل دهند؛ این سلولها در تراکم بالاتر، رشد بیشتری دارند. بنظر میرسد این سلولها از نظر مرحله تمایز، به سلولهای بنیادی جنینی نزدیکتر باشند.
کلمات کلیدی: آنزیم آلکالین فسفاتاز، ß-catenin، بند ناف، سلول های بنیادی جنینی، سلول بنیادی مزانشیمی، Wst-1
زمينه و هدف
سلول بنيادي به سلولي گفته ميشود كه توانایی
خود نوسازي و تمایز به سلولهاي ديگر را داشته باشد (1). سلولهاي بنيادي به سلولهاي بنيادي روياني و سلولهاي بنيادي بالغين طبقهبندی میشوند. بنظر میرسد سلولهاي بنیادي خون و ماتریکس بند ناف حد واسط سلولهای بالا هستند. در سال 1991 از ژله وارتون بند ناف نوزاد انسان، سلولهای شبیه به فیبروبلاست بدست آمد که قابلیت تکثیر زیادی داشتند (2). دوازده سال بعد، در سال 2003 از ماتریکس بند ناف، جمعيت سلولي بنام سلولهای مزانشیمی بند ناف (UCM) جدا شد كه توانايي تكثير نامحدود و تمايز به بافتهاي عصبي و گليال را داشتند (3). مطالعات نشان داده که سلول¬هاي UCM قادرند در محیط کشت به سلول¬هاي عصبي، عضلاني (4)، قلبي (5)، غضروفی و استخوانی (6) تمایز یابند. همچنین تزریق این سلولها به مغز موش صحرایی باعث بهبود علایم پارکینسون موشها و تمایز این سلولها به سلولهای عصبی شده است (7)؛ بر اين اساس، مي¬توان اين سلولها را در زمره سلولهاي پرتوان به شمار آورد (2،5).
ژله وارتون بند ناف شامل بافت همبند مشتق شده از مزودرم خارج جنینی و سلول¬هاي شبه ¬فيبروبلاست است (2). در بعضی از مطالعات، وجود ساختارهای مولکولی انقباضی در این سلولها گزارش شده و بر همین اساس به آنها میوفیبروبلاست نیز گفته شده است (4). از زمان معرفی سلول¬هاي بنیادی ماتريكس بند ناف تاکنون، مطالعات اندکی به بررسی ویژگی¬های این سلولها در محیط کشت پرداختهاند. این سلولها رسپتورهاي سطحي CD44 و CD105 و ماركرهاي داخلي CD51و CD29را بيان مي¬كنند؛ در حالیکه بيان CD105 و CD49e در اين سلولها بر خلاف سلولهاي بنيادي مشتق از مغز استخوان، در جمعيتهای کوچک سلولی و در پاساژهاي ابتدايي (قبل از پاساژ 8) صورت مي¬گيرد و بعد از این مرحله دیگر این مارکرها بیان نمیشوند (9). بعلاوه سلولهای مزانشیمی بند ناف، ماركرهاي هماتوپوئيتيك CD34، CD45، CD14، CD33 و CD56 را بيان نمي¬كنند. این سلولها همچنین ماركرهاي سطحی سلولهاي بنيادي مزانشيمي از قبيل SH3 و SH2 را بيان ميكنند (8). از سويي بيان فاکتورهاي رونويسي Nanog، Oct-4 و Sox-2 در سلول¬هاي بنيادي ماتريكس بند ناف خوک (10) و موش صحرایی (11) و اسب (12)، نشان دهنده پرتوانی و قابلیت خودنوسازی این سلولها است. بعلاوه سلولهای ماتریکس بند ناف خوک در محیط کشت، کلنیهای آلکالین فسفاتاز مثبت تولید کردهاند (10). این سلولها فاکتورهاي رشد و فاکتورهای دخیل در رگزایی را نیز به فراوانی تولید ميکنند. اين شواهد نشان مي¬دهد كه سلول¬هاي مزانشیمی ماتريكس بند ناف نسبت به سلولهاي بنيادي بالغين خصوصیات جنيني بیشتری دارند (14).
علیرغم پارهای گزارشات که برخی خصوصیات سلولهای بنیادی بند ناف انسان را نشان دادهاند؛ ولی تاکنون ویژگیهای این سلولها در ارتباط با میزان تراکم سلولی بررسی نشده است. این در حالی است که مشاهدات ثبت نشده ما حاکی از تغییر در رفتار سلولهای ماتریکس بند ناف بدنبال تغییر در تراکم این سلولها میباشد. لذا مطالعه حاضر به بررسی ویژگیهای سلول¬های بنیادی ماتریکس بند ناف انسان در محیط کشت و ارتباط این ویژگیها با تراکم سلولی میپردازد. تغییر خواص احتمالی این سلولها در تراکم
بالا و پایین با بررسی فعالیت آنزیم آلکالین فسفاتاز
به عنوان یک فاکتور سلولهای بنیادی بررسی میشود. بعلاوه برای تعیین میزان فعالیت سلولی در جمعیتهای مختلف، فعالیت میتوکندری سلولها با اندازهگیری غلظت NADPH توسط کیت Wst-1 بررسی میشود.
روش¬ بررسي
کلیه مواد استفاده شده در این پژوهش از شرکت سیگما (Sigma, USA) خریداری شده، مگر مواردی که به آن اشاره شده است. این پژوهش پس از اخذ مجوز از کمیته اخلاق در پژوهش دانشگاه علوم پزشکی کرمان انجام شد.
جداسازی سلولها و تهیه کشت اولیه: بند ناف نوزاد سالمی که به روش سزارین متولد شده بود، پس از کسب رضایت از مادر در شرایط استریل در محلول HBSS حاوي پنیسلین (IU/ml100) و استرپتومایسین سولفات (g/ml60) و آمفوتریسین B (g/ml10)، به آزمایشگاه کشت سلولی منتقل گردید. جداسازی سلولهای hUCM به روشی که برای جداسازی سلولهای بند ناف خوک استفاده شده بود (10)، با تغییرات جزیی به شرح زیر انجام شد. در شرایط استریل، پس از شستشوی بند ناف با PBS، آمنیون و عروق بند ناف به دقت جدا شد و ماتریکس به جا مانده به قطعاتي به قطر حدود mm5 تقسیم شد. قطعات ماتریکس بند ناف به پتری¬ دیشهای 10×35 میلی متری (Falcon BD, USA) منتقل و ml1 محیط کشت DMEM/F12 حاوي 20% سرم جنين گاو (Gibco, Australia) و IU/ml100 پني¬سيلين و µg/ml50 استرپتومايسين سولفات به هر ظرف اضافه شد. در روز بعد ml3 محیط کشت به پتری دیشها اضافه شد. پس از كشت و نگهداری سلولها در مدت 7-5 روز در انکوباتور CO2 دار و در دماي C37، جوانه¬های سلولی در کنار قطعات ظاهر شدند. پس از مشاهده جوانه¬های سلولی، قطعات ژله وارتون از محیط خارج شدند و کشت سلولها تا رسیدن به تراکم بیشتر از 80%
ادامه یافت.
تشكيل كلني سلولهاي ماتريكس بند ناف: سلولها به کمک g/l5/0 تریپسین و g/l2/0 EDTA، از کف پلیت جدا شده، به تعداد 105×1در پلیتهای کشت10×35 (Falcon BD, USA) حاوي محيط كشت DMEMF12 به همراه 10% سرم جنين گاو (FBS) كشت داده شدند. پس از 4 الي 5 روز، سلولها حداقل 80-70% سطح فلاسك را پر كردند. پس از رسيدن به سطح اشباع بالاي 90%، وضعیت سلولها از نظر ایجاد کلنی روزانه بررسی میشد.
کشت سلولها در قطره معلق: سلولها پس از تعلیق به تعداد 106×1 سلول در میلی لیتر در قطرات معلق 50 میکرولیتری محیط کشت قبلی کشت داده شدند. به این منظور ابتدا قطرات 50 میکرولیتری محیط کشت در درب پتری دیشهای 60×15 قرار گرفت و پس از انتقال سلولها به قطرات محیط کشت، درب پتری دیشها بطور وارونه روی پتری دیشی که کف آن ml3 آب مقطر استریل ریخته شده بود، قرار داده شد. پتری دیش حاوی قطرات محیط کشت بمدت 48 ساعت در انکوباتور C37 با 5% CO2 نگهداری شدند. کلنیهای سلولی بدست آمده توسط کیت آلکالین فسفاتاز رنگآمیزی شدند و بیان آلکالین فسفاتاز در آنها بررسی شد.
بررسي بيان آلكالين فسفاتاز در كلنيهای سلولی: تعداد 105×1 سلول در پتري ديش¬هاي 10×35 میلیمتری حاوي محيط DMEM F12 داراي 10% سرم كشت داده شدند. پس از رسيدن سلولها به سطح اشباع لازم جهت تشكيل كلوني، پتري ديشها دو مرتبه با PBS شسته و پس از آن با كيت آلكالين فسفاتاز سیگما مطابق با دستورالعمل کمپانی سازنده رنگآميزي شدند. در این روش در صورت وجود آنزیم آلکالین فسفاتاز در سلول، آنزیم با ماده naphthol AS-BI و fast red violet LB واکنش نشان داده و رنگ قرمز تیره تولید میکند که توسط میکروسکوپ نوری قابل بررسی است. پلیتهای رنگآمیزی شده با درشت نمایی100× و 400× میکروسکوپ نوری (Zeiss, Germany) بررسی شدند. سلولهایی که به رنگ قرمز تیره در آمده بودند، آلکالین فسفاتاز مثبت تلقی میشدند.
بررسي میزان رشد سلولها در جمعيتهای متفاوت: تعداد 125، 250، 500 و 1000 سلول در l100 محیط کشت به چاهکهای پليتهاي كشت 96 خانهاي اضافه گرديد. برای تعیین میزان فعاليت جمعيتهای مختلف سلولي، جذب نوری تعداد برابری از چاهکها یک ساعت پس از اضافه کردن سلولها و بار ديگر پس از 48 ساعت به کمک محلول Wst-1 (Roche, Germany) سنجيده شد. در این روش، NADPH میتوکندری با احیاء محلول فورامازان، رنگ قهوهای ایجاد میکند که با دستگاه اسپکتروفوتومتر با طول موج 450 نانومتر قابل اندازهگیری است. به اين منظور l10 محلول Wst-1 به هر يک از چاهک¬هاي حاوي سلول افزوده شد و پس از يک ساعت نگهداری در دمای C37، ميزان جذب نور در طول موج nm450 و طول موج رفرانس nm630 با دستگاه الایزا ریدر (BioTek, USA) اندازه¬گيري شد. از محيط کشت بدون سلول، بعنوان بلانک استفاده شد. آزمایشات سه بار تکرار و در هر تکرار، سه چاهک برای هر سلول در نظر گرفته شد. جذب نوری چاهکها پس از 48 ساعت به جذب نوری اولیه تقسیم شد و میانگین نسبت جذب نوری در هر یک از غلظتهای سلولی محاسبه؛ سپس به کمک نرمافزار SPSS منحنی مربوطه رسم شد.
نتايج
بررسی مورفولوژی و فعالیت آلکالین فسفاتاز سلولها:
7-5 روز پس از قرار دادن قطعات ژله وارتون در محیط کشت، جوانه¬های سلولی از کناره¬ها شروع به رشد کردند و یک هفته بعد كف پلیتها را پوشاندند. دو نوع سلول چسبنده در بستر پلیت مشاهده شد؛ سلولهایی که دارای زوائد سیتوپلاسمی منشعب و شبیه به سلولهای مزانشیمی بودند و سلولهای دوکی شکل كه بیشتر شبیه به سلولهای فیبروبلاست بودند. این سلولها همزمان با افزایش تراکم، ساختارهایی شبیه به کلنیهای سلولی به وجود میآوردند (شکل 1- الف). این کلنیها پس از رنگآمیزی با کیت آلکالین فسفاتاز، به رنگ قرمز تند درآمدند (شکل 1-ب)؛ در حالیکه سلولهایی که بصورت تک¬لايه رشد کرده بودند، عمدتاً فاقد فعالیت آلكالين فسفاتاز بودند؛ ولی بندرت در تعدادی از سلولهاي مجزا نیز فعاليت آنزيم آلکالین فسفاتاز مشاهده شد.
تولید کلنیهای سلولی: 48 ساعت پس از قرار دادن سلولها در قطره معلق، ساختارهای تشکیل شده به دقت توسط میکروسکوپ معکوس بررسی شدند. این ساختارها شامل اجتماع توده¬های سلولی بودند كه
از نظر بیان آنزیم آلکالین فسفاتاز بررسی شدند و رنگ قرمز تند حاصله، نشان¬دهنده فعالیت آنزيم آلکالین فسفاتاز در این اجسام بود (شکل1- ج).
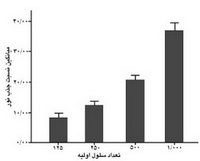
تعیین ارتباط تعداد اولیه سلولهای کشت شده با شدت فعالیت سلول: به منظور بررسی رفتار سلولهای ماتریکس بند ناف در جمعیتهای مختلف، 48 ساعت پس از کشت سلولها، محلول Wst-1 به چاهکهای مربوطه اضافه و میزان فعالیت میتوکندری سلولها اندازهگیری شد. اطلاعات بدست آمده نشان داد كه اين سلولها توانايي تقويت رشد يكديگر را دارند. نمودار 1 بيانگر اين نكته ميباشد كه در جمعيت¬هاي سلولي متفاوت، نسبت رشد سلولها كه بوسيله كيت Wst-1 سنجيده شده است، تغيير ميكند؛ به عبارت دیگر، سرعت تکثیر و رشد سلولها با افزایش تعداد سلول افزایش مییابد.
بحث
سلولهای مزانشیمی ماتریکس بند ناف را میتوان از بند ناف نوزاد که مادهای دور ریختنی است و استفاده از آن مشکل اخلاقی خاصی ندارد، تهیه کرد. این سلولها در سالهای اخیر با توجه به سهولت تهیه، خواص آنتیژنی کم و قابلیت تکثیر و تمایز به سایر ردههای سلولی، مورد توجه زیادی قرار گرفتهاند و پیشنهاد شده است که از آنها در سلول درمانی و برای اصلاح ساختارهای بیولوژیک آسیب دیده استفاده شود (6،13). سلولهای ماتریکس بند ناف که از نظر خواص انقباضی و ترشح فراوان کلاژن سلولهای شبه- میوفیبروبلاست نام گرفتهاند، قادرند با ترشح ماتریکس بند ناف، قطر عروق بند ناف را تنظیم و میزان عبور خون از عروق را کنترل کنند (4،21). این سلولها از مزودرم خارج جنینی مشتق میشوند و با توجه به منشاء جنینی و عدم بیان مارکرهای آنتیژنی سطحی مانند HLA-II ، احتمالاً واکنشهای ایمنی را در حیوانات گیرنده سلول بر نمیانگیزانند (14). البته در مطالعه Cho و همکاران، تزریق سلولهای مزانشیمی بند ناف در نوبت اول، باعث تحريك پاسخهای ایمنی نميشود؛ ولی با افزایش دفعات مواجهه، به تدریج پاسخهای ایمنی شروع ميشود (15).
سلولهای مزانشیمی بند ناف از قدرت تکثیر بالایی برخوردارند و علیرغم پراکندگی و تعداد کم آنها در ژله وارتون، قادرند مقادیر زیادی اسید هیالورونیک و بافت همبند بسازند (16). همچنین این سلولها به فراوانی فاکتورهای رشد از جمله βTGF- ، IGF-I و EGF (17) وGDNF (10) را ترشح میکنند که این فاکتورها قادرند تکثیر و رشد سایر سلولها را تحت تأثیر قرار دهند. یافتههای ما نشان داد که سلولهای ماتریکس بند ناف انسان در محیط کشت به سهولت و سرعت رشد کرده و تکثیر مییابند. هر چند از نظر مورفولوژی تفاوت آشکاری بین سلولها مشاهده نمیشود. ولی با گذشت زمان و بر اساس تشکیل کلنی، سلولها را میتوان دو دسته کرد. دستهای از سلولها با شکل و خواص شبیه به فیبروبلاستهای بالغ که در محیط کشت بصورت تک لایه رشد میکنند و پس از تماس با سلولهای مجاور، به دلیل خاصیت مهار تماسی ، تکثیر آنها کند میشود و دسته دوم سلولهایی که پس از تکثیر، کلنی تشکیل میدهند و اندازه این کلنیها با گذشت زمان افزایش مییابد. Karahuseynoghlu و همكاران، (18) این سلولها را به دو دسته تقسیم کردند؛ سلولهای دوکی شکل که سایتوکاین زیادی تولید میکنند و سلولهای کشیدهای که قابلیت زیادی برای تمایز به سلولهای عصبی دارند. رنگآمیزی سلولها با آلکالین فسفاتاز نشان داد که برخلاف اغلب سلولهایی که به صورت تک لایه رشد میکنند، کلنیهای سلولی، آلکالین فسفاتاز مثبت هستند. سلولهای مزانشیمی بند ناف خوک نیز پس از کشت در آزمایشگاه، آلکالین فسفاتاز مثبت بودند (10). از آنجا که همین خاصیت در سلولهای بنیادی جنینی نیز وجود دارد (19)، سلولهای ماتریکس بند ناف انسان را از نظر پرتوانی میتوان نزدیک به سلولهای بنیادی جنینی دانست؛ همچنین تولید پروتئین Oct-4 به عنوان اصلیترین عامل مرتبط با پرتوانی سلول که در سلولهای بنیادی جنینی بیان میشود، این فرضیه را تقویت میکند (19،20). مطالعات در موش صحرایی (11)، خوک (10) و اسب (12)، بیان Oct-4 را در سلولهای ماتریکس بند ناف نشان داده است؛ بدین ترتیب میتوان احتمال داد که با توجه به آلکالین فسفاتاز مثبت بودن کلنیهای سلولی در مطالعه حاضر، این سلولها Oct-4 مثبت نیز باشند (که البته تأیید این مطلب نیاز به بررسی بیان پروتئین Oct-4 در این سلولها دارد). این سلولها با توجه به قابلیت تکثیر زیاد و ترشح فاکتورهای رشد (17)، هنگامیکه در قطره معلق نگهداری شدند، ضمن اتصال به یکدیگر و تشکیل کلنی- که از خواص سلولهای بنیادی جنینی است- به شدت آنزیم آلکالین فسفاتاز را بیان میکردند که این ویژگی نیز در سلولهای بنیادی جنین دیده میشود.
کشت سلولهای ماتریکس بند ناف انسان با تراکمهای متفاوت نشان داد که هر چه تراکم اولیه سلولها بیشتر باشد، تکثیر و فعالیت سلولی افزایش مییابد. مطالعات چندی نشان داده که سلولهای ماتریکس بند ناف قابلیت زیادی برای ترشح فاکتورهای رشد مختلف دارند. فاکتورهایي از قبیل TGF-β، EGF، PDGF وIGF در سلولهای ماتریکس بند ناف به نسبت زیادتری نسبت به سلولهای دیواره شریانهای بند ناف ترشح میشوند (17). همچنین ضریب تولید این فاکتورها در مقایسه با میزان DNA سلولها بالاتر از سلولهای دیواره شریانهای بند ناف بوده است؛ به بیان دیگر، سلولهای ماتریکس بند ناف فاکتورهای رشد بیشتری تولید میکنند. بنظر میرسد در مطالعه حاضر که سرعت رشد سلولی با افزایش تعداد اولیه سلول کشت داده شده تراکم سلول افزایش مییافت، حضور فاکتورهای رشد مترشحه از سلولهای ماتریکس بند ناف و اتصال این فاکتورها به گیرندههای کنترل کننده رشد سلولی باعث شده که با افزایش تراکم سلولی، سلولها تکثیر و فعالیت بیشتری داشته باشند. این نظر با مشاهدات Jumora و همکاران همخوانی دارد. آنها ابتدا برای ایجاد آسیب مغزی ماندگار، قلب موشهای صحرایی را بمدت 8 دقیقه از کار انداختند. سپس سلولهای ماتریکس بند ناف موش صحرایی را به مغز موشها تزریق کردند و نتیجه کار را بررسی کردند. آنها تنها تعداد کمی سلولهای ماتریکس بند ناف تزریق شده را در محل ضایعه مغزی پیدا کردند؛ ولی نورونهای سالم بیشتری در محل ضایعه وجود داشت. آنان در مطالعه خود این نظریه را مطرح کردند که احتمالاً ترشح فاکتورهای رشد توسط سلولهای تزریق شده، باعث تکثیر سلولهای بنیادی خودی، تمایز این سلولها و در نتیجه کاهش شدت ضایعه شده است (11).
خواص شبه جنینی این سلولها از سویی و عدم تحریک پاسخهای ایمنی حیوانات دریافت کننده سلول در مطالعات مختلف و سهولت دستیابی به آنها، سلولهای ماتریکس بند ناف را به یکی از مناسبترین سلولها برای سلول درمانی تبدیل کرده است (6،11). گروههایی که در چند سال اخیر پیرامون خواص و کاربردهای این سلولها تحقیق کردهاند، این سلولها را جایگزین مناسبی برای درمان بیماریهای دژنراتیو میدانند (14). مطالعات منتشر نشده ما که در زمینه استفاده از این سلولها در درمان مشکلات اسکلتی- عضلاتی و قلبی بوده است نیز نویدبخش این مسئله است. البته نباید از نظر دور داشت که تاکنون گزارشی مبنی بر احتمال سرطانزایی این سلولها دریافت نشده است و قبل از استفاده از اين سلولها در کارآزماییهای بالینی از این دیدگاه نیز بایستی این سلولها مورد بررسی قرار گیرند تا بتوان با اطمینان بیشتر از آنها در سلول درمانی استفاده کرد.
نتیجه گیری
یافتههای مطالعه حاضر نشان میدهد سلولهای ماتریکس بند ناف انسان با روشی ساده در آزمایشگاه تکثیر میشوند و کلنی تشکیل میدهند. فعالیت آلکالین فسفاتاز مثبت در این سلولها تا حدودی نشان دهنده پرتوانی این سلولها است. با توجه به سرعت تکثیر زیاد این سلولها در محیط کشت، بیان آنزیم الکالین فسفاتاز در آنها و افزایش سرعت تکثیر این سلولها در جمعیتهای سلولی بیشتر، میتوان این سلولها را واجد خصوصیات سلولهای بنیادی دانست.
تشکر و قدرداني
در تهیه بند ناف نوزادان، پرسنل اطاق عمل زایمان بیمارستان مهندس افضلیپور کرمان همکاری صمیمانهای داشتهاند که بدینوسیله از آنان قدردانی میشود.
شکل ها، نمودارها و جدول ها
 |
 |
K?rbling M, Estrov Z. Adult stem cells for tissue repair - a new therapeutic concept? N Engl J Med. 2003;349 (6):570-82. [PubMed]
McElreavey KD, Irvine AI, Ennis KT, McLean WH. Isolation, culture and characterisation of fibroblast-like cells derived from the Whartons jelly portion of human umbilical cord. Biochem Soc Trans. 1991;19(1):29S. [PubMed]
Mitchell KE, Weiss ML, Mitchell BM, Martin P, Davis D, Morales L, et al. Matrix cells from Whartons jelly form neurons and glia. Stem Cells. 2003;21(1):50-60. [PubMed]
Kobayashi K, Kubota T, Aso T. Study on myofibro-blast differentiation in the stromal cells of Whartons jelly: expression and localization of alpha-smooth muscle actin. Early Hum Dev. 1998;51(3):223-33. [PubMed]
Kadner A, Hoerstrup SP, Tracy J, Breymann C, Maurus CF, Melnitchouk S, et al. Human umbilical cord cells: a new cell source for cardiovascular tissue engineering. Ann Thorac Surg. 2002;74(4):S1422-8. [PubMed]
Bailey MM, Wang L, Bode CJ, Mitchell KE, Detamore MS. A comparison of human umbilical cord matrix stem cells and temporomandibular joint condylar chondrocytes for tissue engineering temporoman-dibular joint condylar cartilage. Tissue Eng. 2007;13 (8):2003-10. [PubMed]
Medicetty S, Bledsoe AR, Fahrenholtz CB, Troyer D, Weiss ML. Transplantation of pig stem cells into rat brain: proliferation during the first 8 weeks. Exp Neurol. 2004;190(1):32-41. [PubMed]
Wang HS, Hung SC, Peng ST, Huang CC, Wei HM, Guo YJ, et al. Mesenchymal stem cells in the Whar-tons jelly of the human umbilical cord. Stem Cells. 2004;22(7):1330-7. [PubMed]
Weiss ML, Medicetty S, Bledsoe AR, Rachakatla RS, Choi M, Merchav S, et al. Human umbilical cord matrix stem cells: preliminary characterization and effect of transplantation in a rodent model of Parkin-sons disease. Stem Cells. 2006;24(3):781-92. [PubMed]
Carlin R, Davis D, Weiss M, Schultz B, Troyer D. Expression of early transcription factors Oct-4, Sox-2 and Nanog by porcine umbilical cord (PUC) matrix cells. Reprod Biol Endocrinol. 2006;4:8. [PubMed]
Jomura S, Uy M, Mitchell K, Dallasen R, Bode CJ, Xu Y. Potential treatment of cerebral global ischemia with Oct-4+ umbilical cord matrix cells. Stem Cells. 2007;25(1):98-106. [PubMed]
Hoynowski SM, Fry MM, Gardner BM, Leming MT, Tucker JR, Black L, et al. Characterization and differ-entiation of equine umbilical cord-derived matrix cells. Biochem Biophys Res Commun. 2007;362(2):347-53. [PubMed]
Tian X, Fu R, Deng L. [Method and conditions of isolation and proliferation of multipotent mesenchymal stem cells]. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi. 2007;21(1):81-5. Chinese. [PubMed]
Troyer DL, Weiss ML. Whartons jelly-derived cells are a primitive stromal cell population. Stem Cells. 2008;26(3):591-9. [PubMed]
Cho PS, Messina DJ, Hirsh EL, Chi N, Goldman SN, Lo DP, et al. Immunogenicity of umbilical cord tissue derived cells. Blood. 2008;111(1):430-8. [PubMed]
Raio L, Cromi A, Ghezzi F, Passi A, Karousou E, Viola M, et al. Hyaluronan content of Whartons jelly in healthy and Down syndrome fetuses. Matrix Biol. 2005;24(2):166-74. [PubMed]
Sobolewski K, Ma?kowski A, Ba?kowski E, Jaworski S. Wharton s jelly as a reservoir of peptide growth factors. Placenta. 2005;26(10):747-52. [PubMed]
Karahuseyinoglu S, Cinar O, Kilic E, Kara F, Akay GG, Demiralp DO, et al. Biology of stem cells in human umbilical cord stroma: in situ and in vitro sur-veys. Stem Cells. 2007;25(2):319-31. [PubMed]
Yu X, Jin G, Yin X, Cho S, Jeon J, Lee S, et al. Isolation and characterization of embryonic stem-like cells derived from in vivo-produced cat blastocysts. Mol Reprod Dev. 2008;75(9):1426-32. [PubMed]
Guo Y, Mantel C, Hromas RA, Broxmeyer HE. Oct-4 is critical for survival/antiapoptosis of murine embry-onic stem cells subjected to stress: effects associated with Stat3/ survivin. Stem Cells. 2008;26(1):30-4. [PubMed]
Takechi K, Kuwabara Y, Mizuno M. Ultrastructural and immunohistochemical studies of Wharton s jelly umbilical cord cells. Placenta. 1993;14(2):235-45. [PubMed]
 این وبگاه به منظور دسترسی هر چه بیشتر به مطالب - اطلاعات و آموزش های زنان، بارداری، زایمان و تازه ترین اخبار و مقالات پزشکی-مامایی و پرستاری تاسیس شده است.
این وبگاه به منظور دسترسی هر چه بیشتر به مطالب - اطلاعات و آموزش های زنان، بارداری، زایمان و تازه ترین اخبار و مقالات پزشکی-مامایی و پرستاری تاسیس شده است.